2. VALENCIA Y NUMERO DE OXIDACIÓN
2.1 VALENCIA
Proviene del latín “Valentia”, que significa vigor o capacidad que poseen los átomos de un elemento para combinarse químicamente con otros (enlace químico); pero en la actualidad la interpretación mas aceptable es aquella que nos indica a la valencia como una representación de la cantidad de electrones que el átomo de un elemento puede dar, recibir o compartir con otro átomo cuya cantidad es un número entero que carece de signo.
Ejemplos:
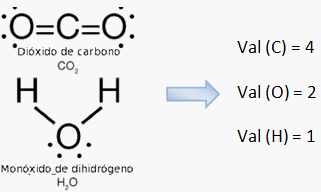
Valencias de los elementos químicos
2.2 NUMERO DE OXIDACIÓN
El numero de oxidación es también conocido como estado de oxidación (E.O.) y es un parámetro numérico que presenta signo el cual nos representa la carga real o aparente que adquieren los átomos de un elemento al formar enlaces químicos con otro de diferente elemento.
Ejemplo:
+1 -2
Na2O
El número de oxidación del Hidrógeno en la mayoría de los compuestos es +1.
El número de oxidación del Oxígeno en la mayoría de los compuestos es -2.
El número de oxidación de un elemento en una sustancia simple es 0 (cero).
2.3 DETERMINACIÓN DEL NUMERO DE OXIDACIÓN
En la formulación de un compuesto conviene tener en cuenta las siguientes normas:
• El número de oxidación de cualquier elemento en estado libre (no combinado) siempre es cero, no importa cuan complicada sea su molécula.
• Un compuesto siempre está formado por unos elementos que actúan con número de oxidación positivo y otros con número de oxidación negativo.
• Al escribir la fórmula del compuesto se coloca primero el o los elementos que actúen con número de oxidación positivo.
• En todo compuesto, la suma algebraica de los números de oxidación de sus elementos multiplicados por los subíndices correspondientes de los mismos, debe ser igual a cero. Por ejemplo, en la fórmula del óxido de aluminio: Al2O3, el aluminio tiene número de oxidación +3 y el oxígeno -2, de manera que: 2 (+3) + 3 (-2) = 0.
• Cuando todos los subíndices de una fórmula son múltiplos de un mismo número, se pueden dividir entre este número, obteniéndose así la fórmula simplificada del compuesto. Por ejemplo, H2N2O6 se debe escribir HNO3.
• La suma algebraica de los números de oxidación de los elementos en un ion debe ser igual a la carga del ion. Por ejemplo, en el ion carbonato, llamamos X al número de oxidación del carbono. Como el oxígeno actúa con número de oxidación -2, se debe cumplir que (+X) + 3(-2) = -2, donde X debe ser igual a 4; así, el carbono actúa con +4.
2.4 NUMERO DE OXIDACIÓN DE ALGUNOS ELEMENTOS COMUNES
• El oxígeno actúa con número de oxidación -2, excepto en los peróxidos donde presenta -1 y en el fluoruro de oxígeno (F2O) donde tiene un número de oxidación atípico de +1, debido a la gran electronegatividad del flúor (4,0).
• El hidrógeno actúa con número de oxidación 1 +, excepto en los hidruros, donde presenta un número de oxidación de -1.
• Los metales de los grupos I, II y III siempre tienen números de oxidación de +1, +2 y +3, respectivamente.
• Los metales de transición presentan, por lo regular dos o más números de oxidación positivos, según el número de electrones que entreguen. Por ejemplo, el cobre tiene dos números de oxidación +1 y +2, mientras que el cromo tiene tres números de oxidación: +6, +3 y +2.
Revisa el siguiente vídeo que explica detalladamente como aplicar estas sencillas reglas para determinar el numero de oxidación de un elemento en un compuesto.


No hay comentarios:
Publicar un comentario